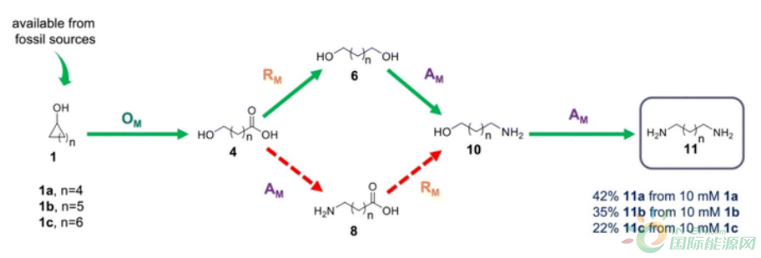
韩国建国大学系统生物技术系Yun教授等报道了从相应的环烷醇合成1,6-六亚甲基二胺(HMD)和相关α,ω-二胺的多酶级联反应。在这项工作中,采用了基于大肠杆菌的模块化策略,将完整的生物合成途径分配到不同的模块中。工程化的转氨酶变体SPTA_R417F通过推动反应向目标产物的形成,对级联产生了有益的影响。这个新的变体对有害的丙酮酸失去了>95%的活性,丙酮酸是通过宿主细胞内的辅助葡萄糖代谢产生的。所设计的大肠杆菌联合体包括各自的模块,以一罐一步骤的方式生产了42%的HMD(来自10 mM的环己醇)。该路线是利用大肠杆菌菌群从相应的环烷醇中生物催化合成HMD和相关α,ω-二胺的第一个例子。
图文解读
工业过程中的多酶级联面临着不可否认的挑战,包括生物催化剂的稳定性、反应条件的兼容性和高底物浓度等等。为了满足工业需求,可以采取不同的策略来调整和改善酶的活性和整个合成过程。各种生物催化剂的可用性提供了在体外和体内建立完全新的酶途径的机会,这些途径是通过生物催化的逆合成方法设计的。目前,HMD的工业化合成是通过化学催化方法从己腈中获得的,这种方法自然是不可持续的,而且对环境不友好,有严重的有害影响。
最近,Li和他的同事报道了将环己烷转化为1,6-己二醇(1,6-diol)的单罐级联反应。开发了包含各自酶的三种大肠杆菌菌株,通过使用所有菌株的混合物,四种环烷和环烷醇(4-20 mM)被转化为相应的二元醇(4-18 mM)。迄今为止,已经报道了几种生物催化方法来合成6-氨基己酸、己二酸和1,6-二醇。然而,只有一种生物催化途径(由Yakunin1b和合作者开发;图1A)被报道用于合成HMD。这个4步酶法级联涉及使用羧酸还原酶(CAR)和转氨酶(TA)分别进行还原和胺化反应,使用分离的酶生物催化剂生产30%的HMD作为目标产品。用于HMD生物合成的模块化级联的发展可能受到限制,因为(1)与必要的辅助因子的可用性有关的复杂性和对涉及使用辅助酶再生的步骤的催化依赖性;(2)存在各种中间产物作为级联的组成酶的竞争底物。
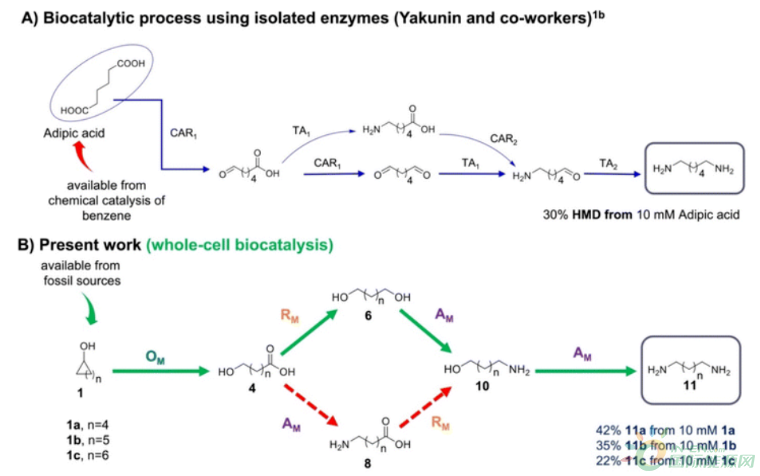 Figure 1. (A) Biocatalytic process for transformation of adipic acid into HMD (11a) by using isolated enzymes. CAR1-indicates wild-type CAR, CAR2-indicates engineered CAR, and TA1/TA2 indicates two different transaminases. (B) An overview of the proposed multienzyme biocatalytic cascade for the synthesis of HMD (11a) from cyclohexanol (1a). The modules in this work are named based on the main catalytic reaction involved: oxidation module (OM) (ADH_AcCHMO_Lactonase); amination module (AM) (AHR_TA); reduction module (RM) (CAR_EnORs_Sfp). The solid green arrows indicate the main catalytic pathway.
Figure 1. (A) Biocatalytic process for transformation of adipic acid into HMD (11a) by using isolated enzymes. CAR1-indicates wild-type CAR, CAR2-indicates engineered CAR, and TA1/TA2 indicates two different transaminases. (B) An overview of the proposed multienzyme biocatalytic cascade for the synthesis of HMD (11a) from cyclohexanol (1a). The modules in this work are named based on the main catalytic reaction involved: oxidation module (OM) (ADH_AcCHMO_Lactonase); amination module (AM) (AHR_TA); reduction module (RM) (CAR_EnORs_Sfp). The solid green arrows indicate the main catalytic pathway.
在此,我们开发了一条从环己醇合成HMD的体内多酶生物催化路线。整个途径分为三个反应模块(图1B)。在模块1(氧化模块;OM)中,环己醇(1a)被酒精脱氢酶(ADH)转化为环己酮(2a),随后被环己酮单氧酶(CHMO)转化为相应的己内酯(3a)。乳糖酸酶(LA)催化己内酯水解为6-羟基己酸(6-HHA;(4a)。路线A通过模块2(还原模块;RM)中的CAR催化6-HHA(4a)的还原,产生相应的醛(5a)。这个醛将被大肠杆菌的内源性氧化还原酶(EnORs)转化为相应的醇,产生1,6-二醇(6a)。最后,1,6-二醇(6a)将在醛还原酶(AHR)和TA的模块3(胺化模块;AM)的催化下进行双胺化,产生HMD(11a)作为所需的化合物。同时,路线B在胺化模块中通过AHR催化6-HHA的氧化和TA的胺化,产生6-氨基己酸(6-AmHA;8a)。此后,6-AmHA经过还原和随后的胺化模块,产生HMD(11a)作为目标化合物(图2)。
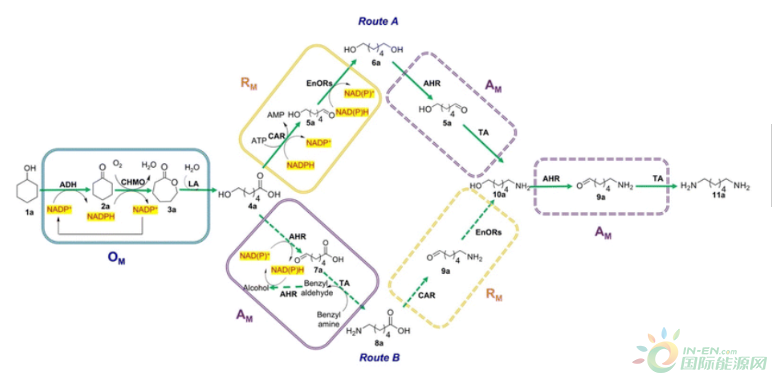
Figure 2. A detailed multistep biocatalytic pathway for the synthesis of HMD (11a) from cyclohexanol (1a) using an E. coli whole cell-based consortia system. ADH: alcohol dehydrogenase; CHMO: cyclohexanone monooxygenase; LA: lactone hydrolase; AHR: aldehyde reductase; TA: transaminase; CAR: carboxylic acid reductase. Solid green arrows indicate the major catalytic pathway. The solid-line squares indicate the E. coli whole-cell and respective module system. The dotted-line squares are simplified versions of the E. coli whole cell-based modules.
在我们早期的工作中,1c单独的辅助因子自给自足的OM和AM模块被报道分别产生>95%的6-HHA(4a)和6-AmHA(8a)。在本工作中,我们重新设计并将OM和AM模块与这个新设计的RM模块相结合。还原模块由来自脓包霉菌的CAR(MaCAR)1b和来自枯草芽孢杆菌的磷酸泛酰转移酶(Sfp)组成,用于翻译后的激活。
大多数CAR生物催化剂已知对长链氨基脂肪酸和羟基脂肪酸具有活性。虽然使用10 mM的6-HHA(4a)底物的反应产生了4mM的1,6-二醇(6a)作为最终产品,但还原6-AmHA(8a)底物仅得到0.81mM的6-氨基-1-己醇(6-氨基醇;10a)。这突出表明,与6-AmHA相比,MaCAR优先利用6-HHA作为底物进行还原。因此,我们首先用50 mM的环己醇(1a)作为理想的底物,将新构成的RM与OM结合起来。这个反应产生了8.13 mM的1,6-二醇(6a),表明RM与OM结合时是一个令人满意的功能,并可以进行协调/优化以进一步改进。与Tris-HCl相比,还原模块在磷酸盐缓冲液中的表现更好;然而,后者已被报道为氧化和胺化模块的最佳缓冲体系。因此,为了以一锅煮的方式结合所有三个模块,我们决定检查氧化和胺化模块在磷酸钾缓冲液中的兼容性。这种一步到位的OM-AM反应实现了50 mM的环己醇(1a)完全转化为6-AmHA(8a;>48mM),表明单锅三模块(OM-AM-RM)反应可以在磷酸钾缓冲液中有效进行。因此,我们使用50 mM的环己醇(1a)底物(总体积25 mL)进行了所有三个模块的联合单锅反应。这个初步的单锅反应没有产生HMD;但是得到了微量(<0.5 21="" silicibacter="" shimia="" phaeobacter="">4 mM和>10 mM的HMD(11a)。同样地,来自铬杆菌(CVTA)和流感弧菌JS17(VFTA)4c的TA对1,6-二醇(6a)显示出中间活性,并从20mM的1,6-二醇(6a)产生>10 mM的6-氨基苯酚(10a)和<1.0 mM的HMD(11a)。接下来,我们测试了两个最佳TA的组合,都是单独表达的,用于胺化模块。值得注意的是,使用单一的TA(SPTA和SMTA)足以将两种底物(6a和10a)双重胺化为HMD(11a)。
阻碍TA催化反应的另一个关键因素可能是细胞内的丙酮酸。用于CAR再生ATP和NADPH的葡萄糖,同时通过固有的代谢(糖酵解)转化为丙酮酸。丙酮酸是TA最活跃的氨基受体之一,丙酮酸的可用性阻碍了整个胺化反应的进行。为了研究代谢产生的丙酮酸的影响,我们测量了在没有环己醇(1a)的情况下TA对氨基供体(苄基胺)的消耗。我们进行了一组5个葡萄糖量从1到10%不等的反应。在所有的反应中,24小时后从200 mM的苄胺中积累了40-45 mM的苯甲醇和1-4 mM的苯甲醛。只有1%(w/v)的葡萄糖足以在反应中产生>40 mM的丙酮酸。
为了找出有效供应辅助因子的葡萄糖的最佳数量,同时确定代谢产生的丙酮酸在级联中的不利作用,在最佳反应条件下,用不同数量的葡萄糖(1-2%;w/v)和50 mM的己内酯(3a)进行反应。这种联合反应产生了50-55 mM的苯甲醇和1-3 mM的苯甲醛。有趣的是,这个反应产生了<2 mM的6-氨基苯酚(10a)和?1.0 mM的HMD(图3A)。在两个反应中,6-AmHA(8a)和6-HHA(4a)的主要积累(分别为10和18 mM)是在底物完全消耗后实现的。这表明1%的葡萄糖是最佳的,添加过量的葡萄糖对HMD(11a)的形成没有好处。尽管形成了目标产物并积累了中间产物,但获得了较多的苯甲醇,这意味着TA生物催化剂在有利的条件下接受丙酮酸作为底物,并干扰TA催化的胺化作用,形成目标产物。值得一提的是,己内酯完全水解为6-HHA(4a),随后积累了6-AmHA(8a),表明氧化模块调得很好,对6-HHA(4a)的偏好相对高于对CAR的偏好,表明AHR催化的氧化步骤的速率比CAR催化的还原反应的速率快得多。这些发现强调了需要一个有效的解决方案,以尽量减少丙酮酸的不利作用,并为CAR提供有效的辅助因子,以推动整个反应向目标产品的形成。因此,我们决定设计TA以减少对丙酮酸的活性,重要的是不改变对所需底物(5a,7a和9a)和胺供体的活性。据报道,大结合袋中的精氨酸残基与丙酮酸的羧基相互作用,从而允许丙酮酸在大结合袋中的容纳。
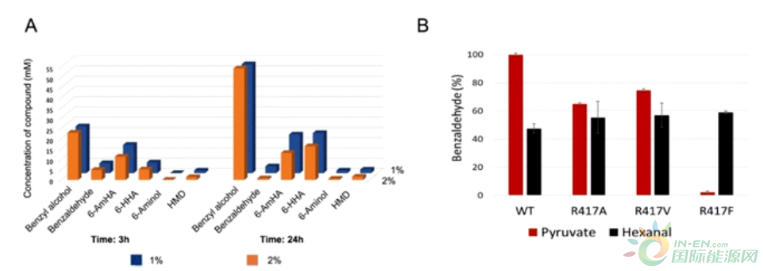
Figure 3. Optimization of the biocatalytic route and engineering of the enzymes in the cascade. (A) Whole cell catalyzed reactions at varying concentrations of glucose to generate cofactors in a one-pot one-step manner. Reaction conditions (total volume: 10 mL): 50 mM caprolactone (3a), 200 mM benzylamine, 0.2 mM PLP, 1–2% (w/v) glucose, E. coli M1C_M2C (27 mgCDW mL?1), E. coli M3B_M3C (27 mgCDW mL?1), 100 mM potassium phosphate buffer (pH 7.5) at 30 °C. (B) Screening and characterization of SPTA variants for activity towards pyruvate and hexanal model substrates. Reaction conditions (total volume: 1 mL): 20 mM pyruvate/hexanal, 40 mM benzylamine, 0.2 mM PLP, E. coli M2A_M2B or E. coli M2A_M2D or E. coli M2A_M2E or E. coli M2A_M2F (9 mgCDW mL?1), 100 mM potassium phosphate buffer (pH 7.5) at 30 °C.
我们通过用丙氨酸(SPTA_R417A)、缬氨酸(SPTA_R417 V)和苯丙氨酸(SPTA_R417F)突变Arg417来设计和构建SPTA的三种不同变体。每个变体的活性都是以丙酮酸和己醛为模型底物来测量的。发现变体SPTA_R417F是理想的候选者,对丙酮酸的活性损失超过95%,但对己醛的活性完全保留(图3B)。SPTA_R417F对丙酮酸的活性最低(22 mU/mg),而对己醛(4.73 U/mg)的活性保留了80%以上。接下来,为了考察SPTA_R417F变体在单锅中的表现,我们使用所有三个模块进行了一个联合的同时反应。不幸的是,这个反应没有得到HMD(11a)作为期望的产物;相反,观察到11.2 mM的6-HHA(4a)和17.2 mM的6-AmHA(8a)以及0.61 mM的1,6-二醇(6a)的积累。该实验表明,CAR催化的还原作用在形成HMD的反应中起到了限制性步骤的作用。正如Yakunin和他的同事所描述的那样,我们构建了MaCAR的变体(MaCAR_L342E),其对6-AmHA(8a)的还原活性增强。为了进一步了解反应性,我们采用已建立的各个模块,以25mL为初始体积进行了连续反应。在步骤1中,OM和RM模块结合起来产生1,6-二醇(6a),随后在步骤2中,进行含有工程SPTA_R417F的AM反应,以获得HMD(11a)作为期望的产物。该反应的步骤1从20 mM的环己醇(1a)中得到7 mM的1,6-二醇(6a)和8 mM的6-HHA(4a)作为最终产物。步骤2从步骤1得到的相应的1,6-二醇(6a)和6-HHA(4a)中得到了3.8 mM的HMD(11a)和8 mM的6-AmHA(8a)(图4A)。这些结果强调了工程化的SPTA_R417F和MaCAR_L342E在级联中发挥了关键作用,HMD(11a)的形成提高了7倍。在这些结果的鼓舞下,我们用10mM的环己醇(1a)作为底物,进行了单锅单步反应。幸运的是,这个反应产生了4.2 mM(42%)的HMD(11a),2.1 mM的6-AmHA(8a;21%),和0.68 mM的6-aminol(10a;?7%)作为最终产品,其他反应中间体的积累可以忽略不计(图4B)。此外,从这些10毫升和25毫升的反应中得到的结果表明,该反应将在制备规模(>100毫升)上有效工作。该级联的性能在从相应的环烷醇(10 mM)合成不同碳链长度的α,ω-二胺时得到了检验,其中通过采用该多酶级联可以实现35%的1,7-二氨基庚烷(11b)和22%的1,8-二氨基丁烷(11c)。虽然观察到反应中间体的少量积累,但所有的中间体都是各种聚酰胺的有用前体。
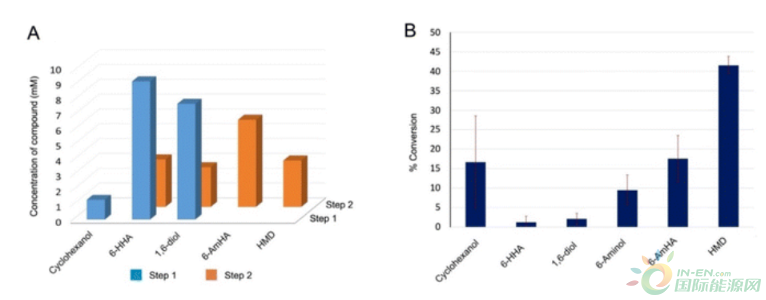
Figure 4. (A) Sequential one-pot two-step reaction for the synthesis of HMD (11a) from cyclohexanol (1a). Reaction conditions (initial volume of step 1: 25 mL; see the ESI?): 20 mM cyclohexanol (1a), 80 mM benzylamine, 0.2 mM PLP, 1% (w/v) glucose, E. coli M1A_M1B (18 mgCDW mL?1), E. coli M1C (6 mgCDW mL?1), E. coli M3B_M3C (27 mgCDW mL?1), E. coli M2A_M2B (18 mgCDW mL?1), 100 mM potassium phosphate buffer (pH 7.5) at 30 °C. (B) One-pot one-step reaction for the synthesis of HMD (11a) from cyclohexanol (1a). Reaction conditions (total volume: 10 mL): 10 mM cyclohexanol (1a), 40 mM benzylamine, 0.2 mM PLP, 1% (w/v) glucose, E. coli M1A_M1B (18 mgCDW mL?1), E. coli M1C (6 mgCDW mL?1), E. coli M3B_M3C (27 mgCDW mL?1), E. coli M2A_M2B (18 mgCDW mL?1), 100 mM potassium phosphate buffer (pH 7.5) at 30 °C.
总结
总之,作者首次成功地展示了从相应的环烷醇合成HMD和相关α,ω-二胺的多酶生物催化路线的例子。这项研究为合成HMD和相关的α,ω-二胺提供了一条有前途的可持续替代路线。构建了基于大肠杆菌的模块,并对单个模块进行了优化/协调,以一步的方式生产目标化合物。TA生物催化剂的工程化为TA作为理想的胺化生物催化剂与其他依赖辅助底物(如葡萄糖)提供连续辅助因子的全细胞生物转化相结合提供了坚实的基础。此处展示的单罐工艺进一步开辟了工程化其他限速酶(如CAR和TA)以及在多步骤级联中调整每个生物催化剂的可能性。虽然CAR的生物催化性能已经通过工程变体得到了改善,但由于目前CAR生物催化剂对短链ω-氨基/羟基酸的固有活性较低,具有不同末端基团(羧基、羰基和胺基)的底物的转化仍然是一个艰巨的挑战。
 切换行业
切换行业



 正在加载...
正在加载...




